ربما تساعد نماذج المخ المصغرة المزروعة في المختبر في تفسير سبب زيادة خطر الإصابة بالخرف لدى الأشخاص الذين يعانون من ارتجاج المخ وإصابات الدماغ الرضحية الأخرى.
في دراسة جديدة نُشرت يوم الخميس (4 أبريل) في مجلة Cell Stem Cell، أبلغ العلماء عن نتائج تجربة قاموا فيها بتفجير هذه النماذج المزروعة في المختبر للدماغ البشري - والمعروفة باسم عضيات الدماغ - بموجات فوق صوتية عالية الكثافة.
كان الهدف من الموجات هو محاكاة تلف خلايا الدماغ الناجم عن إصابات الدماغ الرضحية الشديدة.
أشار البحث إلى استراتيجية لمنع الآثار المترتبة على إصابات الدماغ، كما أفاد مؤلفو الدراسة. من الناحية النظرية، يمكن استخدام العلاج إما كإجراء وقائي أو كعلاج يتم تقديمه بعد الإصابة.
ومع ذلك، هناك حاجة إلى المزيد من الدراسات قبل أن يتم استخدام مثل هذا العلاج في البشر.
بدت عضيات الدماغ المستخدمة في الدراسة مثل كتل من خلايا الدماغ بحجم رأس الدبوس، بدلاً من نسخ مصغرة تمامًا من أدمغة بشرية كاملة الحجم. ومع ذلك، تلتقط العضيات جوانب من البيولوجيا البشرية يصعب دراستها في الحيوانات، مثل فئران المختبر.
يمكن أيضًا زراعتها لتشمل أنواعًا معينة من الخلايا من مناطق مختلفة من الدماغ، مرتبة في طبقات كما لو كانت في رأس الشخص.
في هذه الدراسة، قام الباحثون بزراعة العضيات من خلايا تم جمعها من متبرعين بشريين أصحاء ومن أشخاص مصابين إما بالتصلب الجانبي الضموري (ALS) أو الخرف الجبهي الصدغي، وهما نوعان من الأمراض التنكسية العصبية.
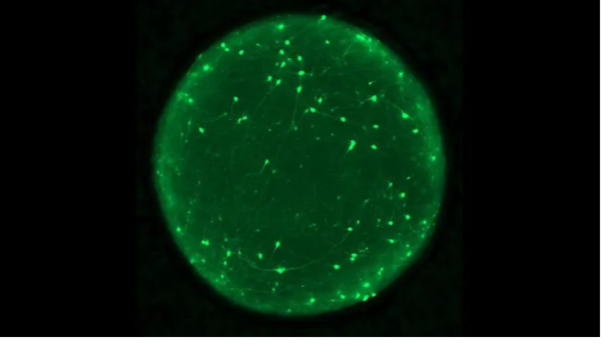
وجد العلماء أن الطفرات في جين يسمى C9orf72 تزيد من خطر الإصابة بكلا المرضين، وفي هذه الحالة، حمل جميع المتبرعين نسخة متحولة من ذلك الجين.
تم تعديل الخلايا التي تم جمعها من كل مجموعة في المختبر بحيث عادت إلى الخلايا الجذعية التي يمكن بعد ذلك إقناعها بالنمو إلى أي نوع من الخلايا.
قام الباحثون بتفجير العضيات الناتجة بنبضات فوق صوتية لمحاكاة بعض تأثيرات إصابات الدماغ الرضحية، بما في ذلك موت خلايا الدماغ والتغيرات في بروتين يسمى تاو، والذي يشارك في مرض الزهايمر.
بالإضافة إلى ذلك، رأى الفريق تغيرات في بروتين يسمى TDP-43، والذي تم ربطه بكل من إصابات الدماغ الرضحية والعديد من الأمراض التنكسية العصبية في الماضي.
يشارك البروتين، الموجود عادةً في نواة الخلايا السليمة، في التحكم في كيفية استخدام التعليمات في الحمض النووي لصنع البروتينات. ولكن في الحالات التنكسية العصبية، يتراكم TDP-43 في كتل.
تشير الأبحاث الجديدة إلى أنه بعد إصابة الدماغ الرضحية، تؤدي بروتينات TDP-43 المعطلة إلى إصابة خلايا الدماغ وقتلها. وجد الفريق أن جزءًا من سبب خروج هذه البروتينات عن السيطرة قد يكون بسبب هروبها من النواة.
كانت هذه التغييرات الضارة في TDP-43 أكثر انتشارًا في العضيات المزروعة من خلايا الأشخاص المصابين بالتصلب الجانبي الضموري أو الخرف مقارنة بتلك الموجودة في المتبرعين الأصحاء.
يشير هذا إلى أنه بسبب هذه الآلية، قد تكون إصابات الدماغ الرضحية خطيرة بشكل خاص لأولئك الذين لديهم بالفعل خطر وراثي للإصابة بالخرف.
بعد ذلك، ذهب الفريق للبحث عن طرق لمنع الإصابات أو عكسها. قال المؤلف الرئيسي جاستن إيشيدا، أستاذ مشارك في بيولوجيا الخلايا الجذعية والطب التجديدي بجامعة جنوب كاليفورنيا، في بيان: "لقد اختبرنا بعد ذلك كل جين في الجينوم البشري لنرى ما إذا كان بإمكاننا إنقاذ تلك الإصابة عن طريق قمع أي جين فردي".
وجدوا جينًا لبروتين على سطح الخلايا - KCNJ2 - والذي عند إيقاف تشغيله، يوفر الحماية من آثار إصابات الدماغ الرضحية. جرب الباحثون ذلك في عضياتهم وفي فئران المختبر، ووجدوا تأثيرات ثابتة.
قال إيشيدا في بيان آخر: "قد يقلل استهداف KCNJ2 من موت الخلايا العصبية بعد إصابة الدماغ الرضحية.
يمكن أن يكون لهذا احتمالية إما كعلاج بعد الإصابة أو كعلاج وقائي للرياضيين وغيرهم المعرضين لخطر كبير للإصابة بإصابات الدماغ الرضحية."
ولكن مرة أخرى، هناك حاجة إلى مزيد من البحث لنقل مثل هذا العلاج من العضيات إلى المرضى من البشر.

























